Удаление грыжи при онкологии
Своевременное лечение грыж передней брюшной стенки, включая паховые, бедренные, пупочные, белой линии живота, позволяет избежать развития таких серьезных осложнений как острая кишечная непроходимость, повысить качество жизни пациентов.
Грыжи передней брюшной стенки, особенно грыжи белой линии живота, у онкологических больных встречаются как последствия ранее выполненных операций на органах брюшной полости, в результате длительно существующего асцита, а также при слабости соединительной ткани, как и у любых других пациентов, не страдающих раком.
В Европейской клинике работают высококвалифицированные хирурги c большим опытом реконструктивной и эстетической медицины. Использование в нашей клинике современных методик и материалов для пластики грыжи, своевременность проведенного хирургического вмешательства позволяет минимизировать количество осложнений, свести к минимуму рецидивы и обеспечить для пациента комфортный послеоперационный период. При помощи современного эндовидеохирургического оборудования хирургическое лечение проводится в соответствии с принципами эстетической и косметической хирургии. Новые методики позволяют проводить сочетанные (симультанные) операции для индивидуального пациента.
Грыжа передней брюшной стенки как заболевание
Собственно грыжа – выпячивание внутренних органов или их части без нарушения целости кожи и выстилающей полость оболочки. Отверстие, через которое это происходит называется грыжевыми воротами. Анатомическое строение передней брюшной стенки таково, что существует несколько «слабых» мест, особенностями своего строения предраспололоженных быть грыжевыми воротами. Чаще всего грыжевыми воротами становится паховое кольцо (66% грыж) и соседняя область, называемая медиальной паховой ямкой. Содержимым грыжевого выпячивания в этом случае могут стать тонкая кишка, сальник, изредка слепая кишка, червеобразный отросток, мочевой пузырь, сигмовидная кишка, внутренние женские половые органы. Грыжевой мешок со временем опускается у мужчин – в мошонку, а у женщин – в большую половую губу. Паховые грыжи по расположению грыжевого канала делят на прямые и косые.
Реже встречаются бедренные, пупочные грыжи, грыжи белой линии живота.
Кроме того, выделяют следующие типы грыж – врожденные и приобретенные, травматические, послеоперационные; полные и неполные, вправимые и невправимые, осложненные и неосложненные.
Как развиваются грыжи
Как правило, пациенты, у которых развиваются грыжи, имеют определенные особенности телосложения и строения соединительной ткани и без того теряющей свою упругость с возрастом. Общее название этих изменений – «синдром слабости соединительной ткани». Современные исследования подтвердили у таких больных нарушения метаболизма коллагена – основного каркасного белка соединительной ткани.
Факторами, способствующими клиническому проявлению грыжи, являются уменьшение (гипотрофия) мышц передней брюшной стенки, повышение внутрибрюшного давления при асците, ожирении, беременности, дискинезии кишечника. Возникновению пупочной грыжи у женщин способствуют многократные беременности и тяжелые роды. Отверстия и щели между мышцами брюшной стенки могут увеличиваться при резком похудании.
Послеоперационные грыжи возникают на месте дефекта ткани, истончения послеоперационного рубца чаще после различных осложнений в области послеоперационного шва (нагноение, инфильтрация и т.п.). У пациентов с онкологическими заболеваниями послеоперационные грыжи могут развиваться на поздних стадиях по факту резкого снижения массы тела, в том числе при развитии раковой кахексии.
Почему необходима операция пластики грыжи
Помимо косметического дефекта и дискомфорта, доставляемого грыжей, существует веская причина не откладывать операцию «в долгий ящик». Эта причина – опасность ущемления, т.е. внезапного сдавления содержимого грыжи в грыжевых воротах. Обычно это происходит после поднятия тяжести, сильного натуживания, во время сильного кашля, т.е. при повышении внутрибрюшного давления. Чаще всего ущемляется подвижная тонкая кишка, в ущемленной части кишки нарушается кровообращение, которое через непродолжительное время приводит к некрозу кишки и даже прободению (перфорации) ее стенки с развитием воспаления брюшины (перитонита) – жизнеугрожающего состояния.
Клинически ущемление грыжи сопровождается существенным увеличением грыжевого выпячивания, его невправлением, напряжением и резкой болезненностью. Боли могут локализоваться только в области грыжи или распространяться над всей поверхностью передней брюшной стенки. Поднимается температура, иногда до высокой – 38-39’C. У некоторых пациентов резко снижается артериальное давление с уменьшением систоло-диастолического интервала, например, до 80/60 мм рт.ст. У некоторых пациентов может быть рвота с примесью желчи и даже кала. Развивается острая кишечная непроходимость.
Обследования для подтверждения диагноза
В неосложнённых случаях грыжи обычно достаточно стандартного предоперационного обследования. Диагноз ставится при обычном клиническом осмотре врачом-хирургом. В сомнительных случаях хирург пробует ввести палец в предполагаемый грыжевой канал и просит пациента натужиться или покашлять. При этом ощущается толчок, свидетельствующий о наличии грыжи. Проведение ультразвукового исследования у пациента в вертикальном положении позволяет обнаружить истончение тканей передней брюшной стенки в области грыжевых ворот.

В осложненных случаях в грыжевом мешке при проведении УЗИ можно обнаружить соответствующие органы – кишечник, мочевой пузырь и прочие.
При наличии тошноты, рвоты, болей и отсутствия ущемления органов в грыжевых воротах приходится исключать другие заболевания с подобной симптоматикой. Бывает, что грыжи белой линии живота сопутствуют язвенной болезни, раку желудка, холециститу и др.
Всегда ли обязательна операция?
Да, всегда. Имеющийся при клинически явной грыже дефект брюшной стенки никакими консервативными мерами или заговорами излечить нельзя. В случае наличия противопоказаний к операции из-за наличия тяжёлых сопутствующих заболеваний пациентам рекомендуется ношение специального бандажа, который несколько замедляет развитие грыжи и препятствует попаданию в грыжевой мешок внутренних органов.
Противопоказания к операции
Острые инфекции, беременность на поздних сроках, дерматит и экзема в области грыжи.
Поскольку операция грыжесечения выполняется при общей анестезии, то наличие декомпенсации тяжелых заболеваний внутренних органов, в том числе, ишемической болезни сердца, инсультов, сахарного диабета, является противопоказанием к операции из-за высокой степени анестезиологического риска.
У онкологических больных грыжа передней брюшной стенки лечится по тем же принципам, что и у остальных пациентов.
Ход операции грыжесечения
Оперативное вмешательство, производимое по поводу грыжи называется грыжесечение или герниопластика. Оно заключается в удалении грыжевого мешка, вправлении внутренностей в брюшную полость и укреплении слабого участка брюшной стенки в области грыжевых ворот.
К настоящему времени существует огромное количество модификаций и усовершенствований традиционной герниопластики, поскольку во все времена при этой патологии была велика частота рецидивов — 10% при простых, 30% и более — при сложных видах грыж.
С середины 80-х годов прошлого века предпочтение отдается “ненатяжной” пластике или пластике грыжевого мешка с минимальным использованием собственных тканей. При ненатяжной пластике для закрытия грыжевого дефекта не производится сшивание с натяжением разнородных тканей, а используются синтетические имплантаты. Рецидивов при ненатяжной пластике несравнимо меньше, меньше выражен болевой синдром в послеоперационном периоде, пациент получает возможность выписаться из стационара спустя 2-3 дня после проведенной операции.
При операции герниопластики, проводимой из обычного (открытого) грыжевого доступа, дно грыжевого канала формируется c помощью синтетической сетки. Эта операция технически гораздо проще, чем эндоскопическая, позволяет быстро вернуться к нормальной жизни, обеспечивает значительно менее болезненный и менее продолжительный, чем традиционные операции послеоперационный период. Всего срок послеоперационной реабилитации – 4-5 суток.
Лапароскопическая трансабдоминальная преперитонеальная герниопластика на сегодняшний день признана наиболее обоснованным и малотравматичным вмешательством при паховых и бедренных грыжах.
- Выполняется из лапароскопического доступа без рассечения покровных тканей.
- Через 3 небольших прокола (диаметром 10 мм и меньше) при помощи специальной аппаратуры в месте формирования грыжи фиксируется синтетическая (чаще полипропиленовая или тефлоновая) сетка.
- Этот способ сложнее технически и дороже, но он предпочтителен при лечении рецидивных, двухсторонних грыж, а также в тех случаях, когда необходимо достичь хорошего косметического эффекта.
- Активизация больного начинается непосредственно после операции.
- При использовании лапароскопического метода обеспечивается кратчайший и практически безболезненный послеоперационный период, раннее восстановление трудоспособности.
Хирурги Европейской клиники проводят герниопластику с использованием сетчатых имплантатов по поводу паховых, бедренных, пупочных, послеоперационных вентральных грыж. Согласно европейской статистике методики хирургического лечения грыж передней брюшной стенки, применяемые в нашей клинике, позволяют сократить число рецидивов грыжи до 1-2%.
Простая и вместе с тем эффективная методика герниопластики с использованием синтетических материалов обеспечивает пациенту отсутствие болей в послеоперационном периоде, быстрое возвращение к активной жизни, хороший косметический эффект и высокое ее качество в отдаленном послеоперационном периоде.
Источник
28 января 2020 г.
Просмотров: 1338
Многие злокачественные опухоли распространяют метастазы на брюшину — тонкую «оболочку», которой покрыты внутренние органы и стенки брюшной полости. Называется это явление (от лат. peritoneum — брюшина) перитонеальный карциноматоз (канцероматоз — не всеми признаваемый, но общепринятый синоним, который мы тоже употребляем). Просовидные (мелкие, как пшено) метастазы рассеяны по всей поверхности брюшины.
Это случается в 50% случаев в абдоминальной онкологии (опухоли ЖКТ или репродуктивных органов). Напомним, колоректальный рак (толстой и прямой кишки) и рак желудка находятся на 2 и 3 месте по количеству смертей среди всех онкозаболеваний.
Средняя продолжительность жизни при карциноматозе брюшины без лечения — от 1,5 до 6 месяцев. Лечить же таких больных еще совсем недавно было нечем. Ни хирургия, ни химиотерапия не справлялись. Пациентов признавали инкурабельными (неизлечимыми). Показатель 5-летней выживаемости в начале 90-х был практически равен 0.
Но последние 20 лет активно развивается методика лечения перитонеального канцероматоза с применением HIPEC (англ. hyperthermic intraperitoneal chemotherapy) — гипертермической интраперитонеальной (внутрибрюшинной) химиотерапии. Методика дает отличные результаты: увеличивает 5-летнюю выживаемость до 40–50%, а иногда дает полное излечение.

Наш эксперт в этой сфере:
Главный хирург, онколог, эндоскопист
Позвонить врачу
В Россию методика HIPEC пришла с сильным опозданием. Кроме нашей «Медицины 24/7» ее до сих пор применяют в считанном количестве клиник даже в Москве, а в регионах это совсем редкий случай. Лечение, которое успешно используется в мире более 20 лет, пациентам в России почти не доступно. Причина — высокая стоимость расходных материалов.
Самое плохое — даже многие врачи не знают, что при канцероматозе существует способ продлить жизнь. Поэтому сегодня мы расскажем про HIPEC подробно: кому это поможет, какие дает результаты и сколько стоит.
Что такое HIPEC
Суть методики HIPEC — в том, что сразу после циторедуктивной (т. е. направленной на удаление опухолевых клеток) операции на брюшине и органах брюшной полости, пациенту в течение 60–90 минут проводят перфузию — «промывают» брюшную полость концентрированным раствором химиопрепарата, нагретым до 42–43 °C.
Цель — уничтожить максимум опухолевых клеток, которые неизбежно останутся даже после самого тщательного хирургического удаления очагов и спровоцируют рецидив.
Свойства, которые делают HIPEC действительно уникальной методикой, мы разъясним чуть ниже, а сначала определимся, при каких диагнозах она может помочь и почему она иногда оказывается единственным способом продлить жизнь человеку на последних стадиях рака.
При каких опухолях образуется канцероматоз брюшины, и почему он так опасен
В брюшную полость распространяются многие из часто встречающихся видов рака.
- рак яичников — в 60–70% случаев приводит к канцероматозу;
- рак желудка — канцероматоз в 40–50% случаев;
- рак поджелудочной железы — в 30–40% случаев;
- рак толстой и прямой кишки (колоректальный рак) — в 10–15% случаев;
- рак печени;
- рак шейки матки;
- рак червеобразного отростка (аппендикса);
- редкие первичные опухоли брюшины (мезотелиома и псевдомиксома).
Все эти злокачественные новообразования распространяют раковые клетки либо когда первичная опухоль физически прорастает в брюшную полость, либо вместе с током крови и лимфы — иногда это происходит во время хирургических операций по поводу первичных опухолей.
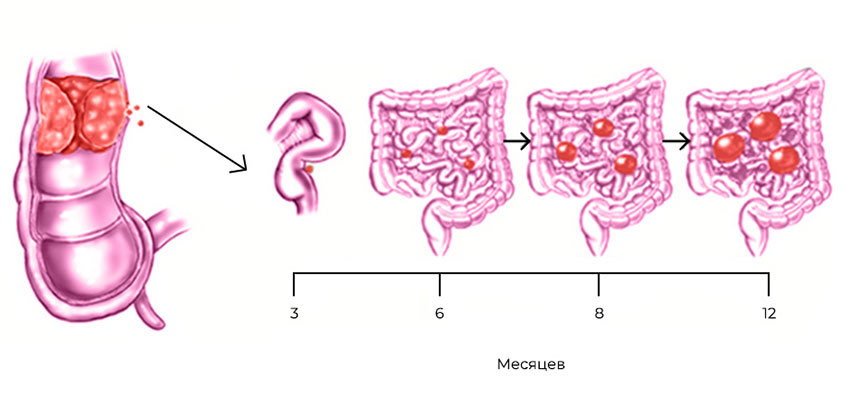 Развитие канцероматоза при колоректальном раке: из прямой кишки в брюшную полость
Развитие канцероматоза при колоректальном раке: из прямой кишки в брюшную полость
Стоит раковым клеткам попасть в полость, ограниченную брюшиной — они, скорее всего, дадут начало вторичным опухолям, метастазам. Перитонеальная ткань — богатый источник факторов роста и комфортная среда для их развития. Микроскопические метастазы распространяются по поверхности брюшины, поражают внутренние органы.
Метастазы нарушают кровоток и лимфоток, лишают внутренние органы питания и пространства, зачастую становятся причиной непроходимостей (например, кишечной, или сдавливают мочеточники). Кроме того, это провоцирует асцит — выпот и скопление жидкости в брюшной полости — наиболее распространенный симптом при канцероматозе.
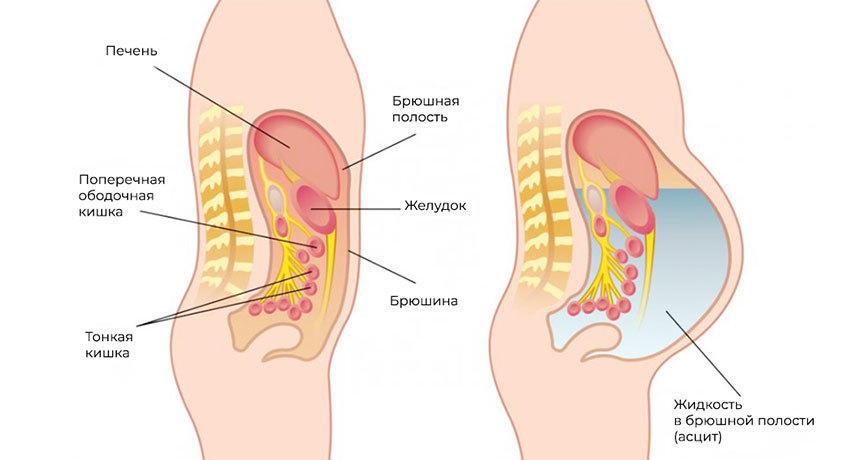
Асцит — скопление жидкости в брюшной полости
Застой крови и лимфы, интоксикация, сдавление внутренних органов метастазами и/или скопившейся жидкостью при асците — это причины, почему пациенты с канцероматозом без лечения не проживают и года.
Другие методы лечения в таких случаях — не работают
На протяжении почти всей истории онкологии считалось, что перитонеальный карциноматоз и опухоли брюшины не поддаются никакому из существующих видов лечения.
Лучевая терапия в лечении канцероматоза не применяется, поскольку высокие дозы облучения такой обширной области живота опасны для пациента еще более серьезными осложнениями.
Хирургическое лечение малоэффективно, т. к. метастазы на поверхности брюшины могут быть микроскопического размера, либо расположены в недоступных местах, и врач не видит их во время операции. А для быстрого рецидива канцероматоза достаточно и единичных раковых клеток, оставшихся в полости брюшины.
Системная химиотерапия почти не дает чувствительного воздействия на опухоли брюшины -опухолевые очаги размером до 3 мм (таких при канцероматозе большинство) практически не развивают систему собственных кровеносных сосудов — и поэтому слабо доступны для системной внутривенной химиотерапии.
Вводить химиотерапию в более высоких дозах, чтобы повысить концентрацию препаратов в перитонеальной области — невозможно, т. к. это может необратимо навредить остальным органам и тканям, до которых доберется перенасыщенный химиопрепаратом кровоток.
Поэтому долгое время считалось, что пациенты с карциноматозом брюшины — неизлечимы. И до сих пор многие врачи — кстати, в разных странах — придерживаются того же мнения. Среди наших пациентов часто бывают те, кого «выписали» из больницы, потому что «канцероматоз нечем лечить». Когда они приходят к нам и узнают про возможность лечения с помощью HIPEC — оказывается, что о такой методике они слышат впервые.
Во второй половине 20 века появились первые работы, рассказывающие о возможностях применения внутрибрюшинной химиотерапии. Последние 20 лет это направление активно развивается, а создал его еще в 80-х годах XX века американский хирург-онколог Пол Шугабейкер — он первым придумал совместить циторедуктивную операцию с горячей химиотерапией, вводимой непосредственно в брюшную полость. И это дало результат
HIPEC — в чем секрет эффективности
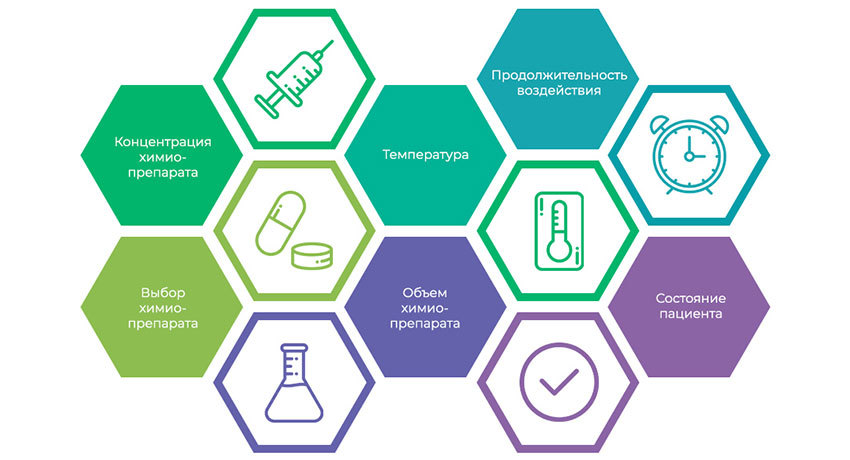 5 параметров, определяющих результативность HIPEC
5 параметров, определяющих результативность HIPEC
В названии «гипертермическая внутрибрюшинная химиотерапия» важны оба прилагательных.
Гипертермия — это повышение температуры.
Высокая температура сама по себе способна вызывать повреждение и гибель опухолевых клеток. К тому же, делает их более уязвимыми для действия химиопрепаратов: усиливает проницаемость клеточных мембран.
Причем чувствительность увеличивается избирательно — опухолевые клетки начинают гибнуть при температуре 40 °C, а здоровые — сохраняются до 44°C. В условиях гипертермии особенности опухолевых тканей (иное кровоснабжение, степень оксигенации, особенности репарации ДНК) становятся для них не преимуществом, а слабым местом.
Кроме того, повышение температуры обычно вызывает иммунную реакцию: растет количество лимфоцитов — клеток иммунитета, способных уничтожать опухолевые клетки. В плазме крови увеличивается уровень интерлейкинов, интерферонов, факторов некроза опухоли и т. д. Все они имеют собственную противоопухолевую активность и дополнительно способны усиливать эффект некоторых химиопрепаратов.
Еще один важный плюс гипертермии — она способствует более активному проникновению препарата в ткани — на глубину до 3 мм — этого хватит, чтобы охватить большинство микро-метастазов, которые останутся после хирургической операции.
Внутри брюшины — химиотерапия работает лучше. Для HIPEC используются стандартные химиопрепараты, но их локальное применение при перитонеальном карциноматозе — куда эффективнее.
Во-первых, химиотерапия контактирует непосредственно с опухолевыми очагами. Локальное прямое воздействие — сильнее, чем через кровоток при внутривенной химиотерапии.
Во-вторых, через брюшину препараты практически не «просачиваются» в общий кровоток.
Это позволяет использовать при HIPEC концентрации химиопрепаратов в 20, 50, а иногда и в 100 раз больше, чем при системной химиотерапии — раковые клетки внутри брюшной полости получают смертельные дозы, а весь организм практически не страдает от побочных эффектов.
Как все происходит
Процедура HIPEC — это, строго говоря, вторая половина целого комплекса мероприятий. Без циторедуктивной хирургической операции HIPEC может проводиться в считанном количестве случаев по особым показаниям. Обычно, процедура — продолжение хирургической операции, которое дает серьезное улучшение прогноза выживаемости.
Вместе с удалением опухолевых очагов, все вмешательство занимает от 6 до 18 часов. Процесс можно разделить на 4 этапа.
1) Ревизия брюшной полости. Проводится она для того, чтобы понять, показано ли лечение с помощью HIPEC для этого пациента, принесет ли оно увеличение продолжительности жизни и улучшение ее качества. Во время ревизии хирург внимательно осматривает брюшную полость и определяет перитонеальный индекс рака (peritoneal cancer index — PCI).
Чтобы его рассчитать, брюшную полость и тонкую кишку условно делят на 13 областей-квадрантов, в каждом из них оценивают самый крупный опухолевый очаг по шкале от 0 до 3:
- очагов не обнаружено — 0 баллов;
- очаги размером менее 0,5 см — 1 балл;
- очаги размером менее 0,5–5 см — 2 балла;
- очаг более 5 см или несколько узлов меньшего размера- 3 балла.
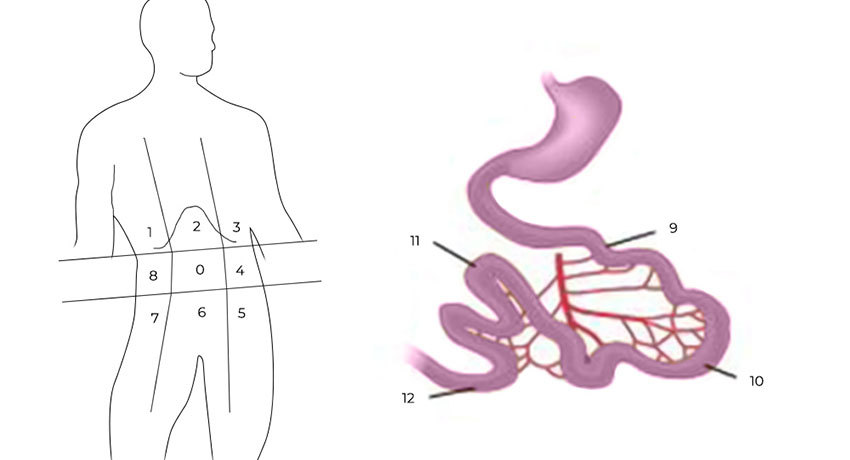 Разделение брюшной полости на участки для определения PCI
Разделение брюшной полости на участки для определения PCI
Баллы суммируются по всем квадрантам — это и есть значение PCI. Чем больше баллов — тем хуже прогноз. Если PCI выше критического (принимая во внимание тип опухоли и состояние пациента) — то и операцию, и процедуру HIPEC могут признать нецелесообразными.
Проводят ревизию интраоперационно, т. е. непосредственно перед проведением основной операции. В некоторых случаях ее можно провести в виде отдельной диагностической лапароскопической операции — малотравматичной, через небольшие проколы в стенке живота.
2) Циторедуктивная операция. Если по результатам ревизии PCI оценен как удовлетворительный, то хирург приступает к удалению всех видимых и пальпируемых (те, что чувствуются наощупь) опухолевых узлов.
Удаляют отдельные участки брюшины, орган, в котором находится первичная опухоль, соседние внутренние органы или их части, если они тоже поражены метастазами. Часто это участки кишечника, селезенка, желчный пузырь.
У нас в «Медицине 24/7» хирурги могут провести у стола на этом этапе и 6, и 9 часов, потому что понимают — от того, как тщательно они выполнят свою работу, зависит то, как эффективно будет и дальнейшая процедура HIPEC. А значит и то, насколько дольше проживет пациент.
3) Гипертермическая интраперитонеальная химиотерапия. Собственно, HIPEC. В брюшную полость вводят катетеры и температурные датчики, соединенные со специальным аппаратом и емкостью с раствором химиопрепарата. Эта перфузионная система (под контролем врачей, конечно) поддерживает заданную температуру и давление циркулирующей жидкости. Раствор химиопрепарата в течение 60–90 минут циркулирует в брюшной полости пациента.
За это время он и чисто механически «вымывает» все сгустки крови и лимфы, на которых опухолевые клетки могли закрепиться. Горячий химиотерапевтический препарат глубоко действует на ткани, где могли остаться невидимые для хирурга микро-метастазы и уничтожает эти зарождающиеся опухоли до того, как они успеют развиться. Кроме того, химиопрепарат активно проникает в лимфоузлы, которых множество в брюшной полости, что препятствует дальнейшему распространению метастазов по организму.
После процедуры препарат удаляют из брюшной полости, промывают ее физраствором, удаляют датчики и катетеры.
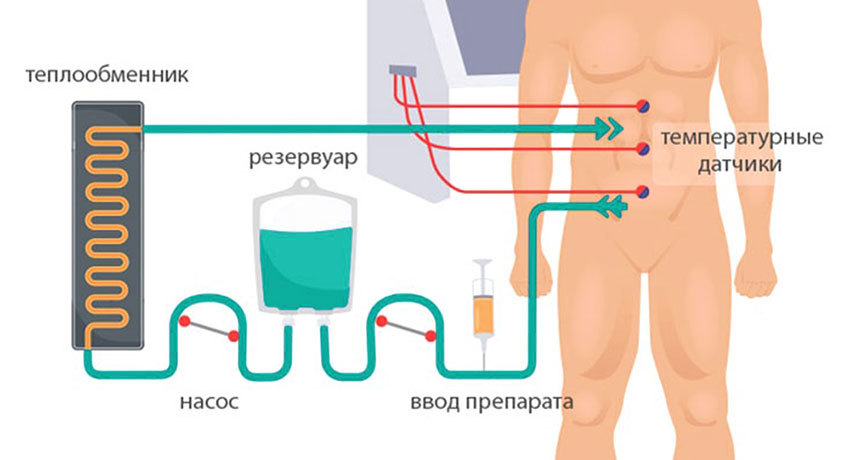 Схема проведения HIPEC
Схема проведения HIPEC
4) Реконструктивная операция. Если удалены части кишечника, хирург восстанавливает непрерывность кишки — формирует анастомоз, выводит верхний конец толстой/тонкой/слепой кишки на поверхность живота для отхождения каловых масс.
В среднем, в клинике пациент проводит 2–4 недели. Через 2–3 недели после операции проводится контрольное обследование. Его необходимо повторять через 3 месяца, и постепенно частоту проверок снижают до 1 раза в год.
В этом видео наши коллеги проводят процедуру HIPEC пациентке с раком яичников.
Как любое лечение, HIPEC имеет риски и противопоказания
Послеоперационный период стоит отдельным этапом, но он не менее важен. Мы всегда понимаем, насколько сложным для наших пациентов (а многие попадают к нам в крайне тяжелом состоянии) может быть период восстановления после такого длительного и достаточно агрессивного вмешательства, как циторедуктивная операция + HIPEC. Поэтому сразу после операции мы переводим пациента в отделение интенсивной терапии, под круглосуточное наблюдение.
Осложнения могут быть те же, что и после любого хирургического вмешательства на брюшной полости, поэтому за пациентом внимательно следят на случай появления признаков кровотечения или воспаления послеоперационной раны — и готовы в любую минуту оказать помощь.
Побочные действия от химиотерапевтического препарата при внутрибрюшной гипертермической химиотерапии даже менее выражены, чем при внутривенном введении — при том, что дозировки, а значит, и противоопухолевое действие, при HIPEC в десятки раз выше.
К сожалению, при всем нашем желании и мастерстве наших хирургов, есть пациенты, для которых полезный эффект вмешательства не оправдает сложностей послеоперационного восстановления.
Чтобы циторедуктивная операция с последующей процедурой HIPEC была эффективной, нужно соблюдение нескольких условий:
- Пациент должен быть в состоянии перенести и хирургическую операцию, и химиотерапию одновременно. Возраст или показатели здоровья не должны этому препятствовать — например, не должно быть почечной или печеночной недостаточности. Перед процедурой мы обязательно всесторонне обследуем пациента.
- Процесс распространения метастазов должен быть ограничен только брюшной полостью. Если есть метастазы в других органах, которые нельзя удалить — они будут распространяться дальше, и сведут эффект HIPEC на нет.
- Метастазы размером более 2,5 мм не должны покрывать всю поверхность брюшины — удалить их все будет невозможно.
Однако, плюсов у HIPEC все же значительно больше, чем ограничений
Большому числу людей нам удается помочь. Одна из таких пациенток попала к нам после лечения в нескольких клиниках — в том числе в Израиле и Сингапуре. Причем, долгое время врачи не находили первичной опухоли, причины прогрессирующего канцероматоза. Оказалось, что еще в 2012 г. ее оперировали по поводу «аппендицита», и не сообщили ей, что в аппендиксе была редкая опухоль — псевдомиксома, За последние 5 лет пациентке сделали 13 операций — их проводили по 2–4 раза в год! Но ни в одном из лечебных учреждений ей не предложили проведение HIPEC, хотя в ее случае это было идеальным решением. Об этой методике пациентка даже не слышала после стольких лет лечения.
Мы провели ей циторедуктивную операцию и процедуру HIPEC, и после этого она уже 10 месяцев живет без прогрессирования заболевания.
В некоторых случаях HIPEC приводит к устойчивому излечению. Например, коллеги из США сообщали о женщине с мезотелиомой брюшины. С помощью HIPEC она преодолела болезнь, уже 3 года живет без признаков рака и смогла родить ребенка.
 Jessica Blackford-Cleeton, которой HIPEC позволила выжить и стать мамой.
Jessica Blackford-Cleeton, которой HIPEC позволила выжить и стать мамой.
Проблемы методики HIPEC в России
К сожалению, HIPEC пока применяется в считанном количестве клиник. Причин этому несколько, и они характерны для всех новых технологичных способов лечения.
- Методика все еще считается инновационной, не все врачи имеют нужный опыт работы. К тому же, для проведения процедуры нужен не 1 и не 2, а целая бригада медиков самой высокой квалификации — это длительная, сложная и напряженная операция.
- Оборудование дорогое, не все страны и не все клиники могут потратиться на перфузионную систему и расходные материалы.
- Врачи бывают довольно консервативны. Кто-то считает, что процедура требует более подробного изучения. А кто-то из них не любит участвовать в проведении гипертермической химиотерапией, потому что опасается за собственное здоровье — испарения химиопрепаратов во время HIPEC могут быть вредными для медиков, которые при этом присутствуют. Хотя, в целом, испарения из закрытого контура минимальны, негативные последствия, даже если есть — не являются необратимыми, врачу нужно лишь более внимательно следить за состоянием почек и печени.
Однако более 70 ведущих хирургов-онкологов из 55 онкоцентров в 14 странах мира, включая США (где и родилась эта процедура),Канаду, Францию и Великобританию, пришли к выводу о том, что HIPEC может существенно повысить ожидаемую продолжительность жизни у пациентов, страдающих канцероматозом, особенно при колоректальном раке.
Клинические исследования из разных стран показывали результаты, когда пациенты после лечения канцероматоза брюшины с применением HIPEC жили 7 лет при опухолях аппендикса, более 5 лет при мезотелиоме брюшины, 5 лет при колоректальном раке, 2 года при раке яичников — тогда как при стандартном лечении их выживаемость колебалась от 2 до 14 месяцев.
Мы в свою очередь убедились в эффективности HIPEC на собственном обширном клиническом опыте. Мы надеемся, что через несколько лет HIPEC будет внедряться в стандарты лечения по ОМС и станет доступна по всей стране. А пока — мы даем пациентам возможность не искать подобную помощь за рубежом, а получить ее в Москве.
Материал подготовлен врачом-онкологом, эндоскопистом, главным хирургом клиники «Медицина 24/7» Рябовым Константином Юрьевичем.
Источник
