Врожденная диафрагмальная грыжа клинические рекомендации

В журнале Canadian Medical Association Journal 29 января 2018 г. опубликовано Канадское руководство по диагностике и лечению врожденной диафрагмальной грыжи.
Рекомендации:
Пренатальная диагностика
– УЗИ измерение наблюдаемого-к-ожидаемому легочно-головного отношения (O/E LHR) должно выполняться между 22 и 32 неделями гестационного возраста для прогнозирования тяжести легочной гипоплазии при изолированной врожденной диафрагмальной грыже.
– При левосторонней врожденной диафрагмальной грыже O/E LHR < 25 % прогнозирует плохой исход. При правосторонней врожденной диафрагмальной грыже O/E LHR < 45 % может прогнозировать плохой исход.
– Для оценки объема лёгких и вовлечения печени в грыжеобразование при умеренной и тяжелой врожденной диафрагмальной грыже необходимо использовать МРТ плода (при наличии МРТ).
Вентилирование
– Новорожденные с врожденной диафрагмальной грыжой и с немедленным расстройством дыхания должны предпочтительно быть интубированы при рождении. Необходимо избегать искусственной вентиляции легких мешком Амбу.
– Необходимо обеспечить седацию всем новорожденным с врожденной диафрагмальной грыжой на ИВЛ. Глубокая седация и нейромышечная блокада должны выборочно проводиться детям с большей необходимостью в вентиляции или кислороде.
– Необходимо использовать Т-переходник (T-piece) с аппаратом ИВЛ, чтобы избежать пиковое давление на вдохе > 25 см Н2О.
– У всех новорожденных с врожденной диафрагмальной грыжой должны быть следующие целевые значения: артериальное рСО2 между 45 и 60 мм рт ст, и рН между 7,25 и 7,40 .
– Необходимо титровать подачу кислорода чтобы достичь уровня предуктальной сатурации как минимум 85 %, но не более 95 %.
– Изначальным режимом ИВЛ для новорожденных с врожденной диафрагмальной грыжой, которым требуется дыхательная поддержка, должен быть щадящяя перемежающаяся принудительная вентиляция (intermittent mandatory ventilation). Высокочастотная осцилляторная ИВЛ (High-frequency oscillatory ventilation) или высокочастотная струйная ИВЛ (high-frequency jet ventilation) должна применяться когда пиковое давление на вдохе, необходимое для контроля гиперкапнии при перемежающейся принудительной вентиляции, превышает 25 см Н2О.
Гемодинамическая поддержка
– Лечение плохой перфузии (время капиллярного наполнения > 3 сек, лактат > 3 ммоль/Л, выделение мочи < 1 мл/кг/час) и снижение АД ниже норм по возрасту должно включать:
— разумное применение кристаллоидов, обычно не превышая 20 мл/кг;
— инотропные препараты, такие как допамин или адреналин;
— гидрокортизон.
– Если плохая перфузия продолжается, необходимо произвести оценку функции сердца (ЭХОКГ, сатурацию в центральных венах).
ЭХОКГ
– Две стандартные ЭХОКГ, одна в течение 48 часов после рождения и вторая на 2 – 3 неделе жизни, необходимы для оценки лёгочного сосудистого сопротивления, функции левого и правого желудочка. При наличии показаний могут понадобиться дополнительные обследования.
Лечение легочной гипертензии
– Ингаляция закиси азота показана при подтвержденной супрасистемной легочной артериальной гипертензии без левожелудочковой дисфункции и с адекватной мобилизацией легких (lung recruitment). При отсутствии клинического ответа или ответа на ЭХОКГ ингаляция закиси азота должна быть прекращена.
– Можно рассмотреть применение Силденафила у пациентов с рефрактерной легочной гипертензией (например не реагирующей на закись азота), либо как дополнение при снятии с закиси азота.
– Милринон должен применяться для лечения дисфункции сердца, особенно если дисфункция сердца связана с легочной гипертензией.
– Простагландин Е1 может применяться для сохранения артериального протока открытым и для снижения правожелудочковой постнагрузки у пациентов с легочной гипертензией с правожелудочковой недостаточностью, либо при наличии закрывающегося артериального протока.
Экстракорпоральная поддержка жизнеобеспечения
– Возможность экстракорпоральной поддержки жизнеобеспечения должна обсуждаться во время пренатальных консультаций по поводу врожденной диафрагмальной грыжи и обсуждение должно включать информацию, что имеющиеся доказательства не показали преимущества по выживаемости при применении экстракорпоральной поддержки жизнеобеспечения.
Операция
Следующие физиологические критерии должны соответствовать до операции:
– выделение мочи > 1 мл/кг/час.
– FiO2 < 0,5 .
– предуктальная сатурация кислорода между 85 % и 95 %.
– нормальное среднее АД в соответствии с гестационным возрастом.
– лактат < 3 ммоль/Л.
– оцененное давление в легочной артерии меньше системного давления.
Если данные критерии не соответствуют в течение 2х недель, то необходимо рассмотреть попытку хирургического лечения, либо паллиативный подход.
– Применение заплатки: для диафрагмальных дефектов, которые не подходят для первичного хирургического лечения, то необходимо применить заплатку большого размера без натяжения из политетрафторэтилена/гортэкс.
– Сравнение открытой операции с минимально инвазивной операцией: минимально инвазивный подход или техника не должна быть использована для хирургической коррекции неонатальной врожденной диафрагмальной грыжи ввиду высокой частоты рецидивов.
– У пациентов на экстракорпоральной поддержке жизнеобеспечения: операцию необходимо избегать до деканюляции. Если пациента не возможно снять с экстракорпоральной поддержки жизнеобеспечения, то необходимо рассмотреть попытку хирургического лечения, либо паллиативный подход.
Ведение (контроль) в длительном периоде
– Рекомендуется стандартизованное мульти-дисциплинарное ведение (контроль) детей с врожденной диафрагмальной грыжей для обеспечения наблюдения и скрининга, оптимальной и своевременной диагностики и лечения, подходящего для уровня риска.
– Рекомендуется выявлять подгруппу выживших пациентов с врожденной диафрагмальной грыжей с высоким риском заболеваемости в долгосрочном периоде, таких как: которым потребовалась экстракорпоральная поддержка жизнеобеспечения, которым для лечения применили заплатку, или которым требовалась респираторная поддержка на 30й день жизни.
Подробнее смотрите в прикрепленном файле.
Источник
Грыжа диафрагмы – протрузия органов брюшной полости в грудную клетку через дефект в диафрагме. Сжатие легких может привести к постоянной легочной гипертензии. Диагноз ставят на основании данных рентгенографии грудной клетки. Лечение подразумевает проведение восстановительной операции.
Обычно диафрагмальная грыжа локализуется в задне-боковой части диафрагмы (грыжа Бохдалека) в 95% случаев; в 85% случаев она расположена слева; в 2% случаев она двусторонняя. По приблизительным оценкам уровень заболеваемости составляет 1–4 на 10 000 живорожденных. Передние грыжи (грыжи Морганьи) гораздо менее распространены (5% случаев). Другие врожденные аномалии присутствуют примерно в 50% случаев, а надпочечниковая недостаточность является относительно распространённой патологией.
Петли тонкой и толстой кишки, желудок, печень и селезенка могут выпирать в плевральную полость на вовлеченной стороне. Если грыжа большая, а количество брюшного содержимого грыжи значительно, лёгкое на поражённой стороне гипопластично. Другие легочные последствия включают недоразвитие легочных сосудов, что приводит к повышению легочно-сосудистого сопротивления и, следовательно, легочной гипертензии. Персистирующая легочная гипертензия приводит к право-левому шунтированию крови на уровне овального окна или через открытый артериальный проток, что препятствует адекватной оксигенации даже при ингаляции кислорода или искусственной вентиляции. Стойкая легочная гипертензия является основной причиной смерти среди младенцев с врожденной грыжей диафрагмы.
Клинические проявления
Дыхательная недостаточность, как правило, наступает в первые несколько часов после рождения, а в тяжёлых случаях – сразу после родов. Когда после рождения новорожденный кричит и глотает воздух, желудок и петли кишечника быстро наполняются воздухом и увеличиваются, что приводит к острым респираторным осложнениям, поскольку сердце и органы средостения сдвигаются вправо (при наиболее часто встречающейся левосторонней грыже), сжимая более здоровое правое легкое. Возможно формирование ладьевидного живота (за счет смещения органов брюшной полости в грудную клетку). Из-за вовлечения гемиторакса могут прослушиваться кишечные шумы (и отсутствовать дыхательные).
В менее тяжелых случаях легкое затруднение дыхания развивается через несколько часов или дней спустя, когда содержимое брюшной полости постепенно формирует грыжу дефект диафрагмы меньшего размера. В редких случаях, проявление порока откладывается на более позднее детство, иногда после перенесения инфекционного энтерита, который вызывает неожиданное выпячивание кишечника в грудную клетку.
Иногда пренатальное УЗИ
Рентгенография грудной клетки
Иногда диафрагмальную грыжу диагностируют на основании данных пренатального УЗИ.
В родильном отделении может возникнуть подозрение на диафрагмальную грыжу, когда у новорожденных с респираторным расстройством наблюдается ладьевидный живот.
После родов диагноз ставят по результатам рентгенографии грудной клетки, которая показывает выпячивание желудка и кишечника в грудную клетку. При серьезном дефекте множество заполненных воздухом петель кишечника заполняют гемиторакс и выявляется контралатеральное смещение сердца и органов средостения. Если рентгенографию проводят сразу после рождения, органы брюшной полости проявляются в виде непрозрачной безвоздушной массы в гемитораксе.
Восстановительная операция
Если грыжа диафрагмы подозревается у новорожденного с респираторным дистресс-синдромом, его следует немедленно интубировать эндотрахеально и провести искусственную вентиляцию лёгких непосредственно в родильном зале. Не стоит использовать мешок АМБУ, поскольку это может заполнить смещенные внутренние органы грудной полости воздухом и усугубить дыхательную недостаточность. Непрерывная аспирация с использованием назогастрального зонда с двойным просветом препятствует дальнейшему прохождению проглоченного воздуха по желудочно-кишечному тракту и усугублению компрессии легкого.
Хирургическое вмешательство необходимо для перемещения кишечника в брюшную полость и закрытия диафрагмального дефекта после стабилизации у новорожденного функции легких, кислотно-щелочного баланса и кровяного давления.
Тяжелая персистирующая легочная гипертензия требует стабилизации перед операцией с ингаляцией оксида азота, который помогает расширить легочные артерии и улучшить системную оксигенацию. По данным проведенных исследований, при использовании экстракорпоральной мембранной оксигенации (ЭКМО) исход улучшается, однако новорожденных с очень тяжелой гипоплазией легких до сих пор спасти не удается. Успешную перевозку тяжелобольных новорожденных с врожденной грыжей диафрагмы и персистирующей легочной гипертензией осуществить очень сложно. Именно поэтому, если грыжу диафрагмы диагностируют при проведении пренатального УЗИ, разумно принимать роды в педиатрическом центре, располагающем средствами для проведения экстракорпоральной мембранной оксигенации.
Вследствие врождённой диафрагмальной грыжи органы брюшной полости могут попасть в грудную полость, поджимая лёгкое и вызывая дыхательную недостаточность новорожденных.
Диагноз ставится на основании рентгенограммы органов грудной клетки.
Лечение проводится путём эндотрахеальной интубации с последующим хирургическим вмешательством.
Источник
Врожденная диафрагмальная грыжа
Врожденная диафрагмальная грыжа – это порок развития диафрагмы, приводящий к нарушению разделения брюшной полости и грудной клетки, а так же к смещению желудка, селезенки, кишечника и печени в грудную полость.
Причины возникновения
Врожденная диафрагмальная грыжа может быть изолированным пороком, а также сочетаться с пороками развития других органов и систем. Большинство случаев врожденных диафрагмальных грыж спорадические.
При врожденной диафрагмальной грыже на 8-10 неделе беременности возникает дефект диафрагмы в результате нарушения процесса закрытия плевроперитонеального канала, и органы брюшной полости могут эвентрировать через дефект в плевральную полость в течение всего периода после возвращения кишечника в брюшную полость (9-10 недели гестации). Наличие органов брюшной полости в грудной клетки ограничивает рост и развитие легких, что приводит к гипоплазии легких с уменьшением общего количества ветвей бронхов и артерий. На стороне грыжи отмечается значительное поражение легкого, однако контралатеральное легкое, как правило, также имеет аномальное строение и меньшую массу по сравнению с нормой.

Частота встречаемости 1 на 4000 живорожденных, соотношение полов 1:1
Диафрагмальная грыжа может сочетаться с пороками сердца, на которые приходится около 20%. Сочетания с пороками центральной нервной системы и мочевыделительной системы составляют по 10,7%. Около 10-12% врожденных диафрагмальных грыж, диагностированных пренатально, являются составной частью различных наследственных синдромов (пентада Кантрелла, синдромы Фринзе, Ланге, Марфана, Элерса-Данлоса и т.д.) или проявлением хромосомных аномалий и генных нарушений. Частота хромосомных аномалий в среднем составляет 16 %. Еще раз следует подчеркнуть, что хромосомные аномалии чаще выявляются только в тех случаях, когда врожденная диафрагмальная грыжа сочетается с другими пороками развития. Следовательно, пренатальное кариотипирование показано во всех случаях наличия сочетанной патологии, для уточнения генеза порока.
Относительно сторон поражения все врожденные диафрагмальные грыжи делятся на:
- Левосторонние около 80%
- Правосторонние около 20%.
- Двусторонние менее 1%.
Клинические проявления
Большинство новорожденных с врожденной диафрагмальной грыжей разворачивают картину дыхательной недостаточности непосредственно в родовом зале сразу после рождения. Очень быстро прогрессирует острая дыхательная недостаточность. При осмотре обращает на себя внимание ассиметрия грудной клетки с выбуханием стороны поражения (обычно слева) и отсутствием экскурсии грудной клетки с этой стороны. Очень характерный симптом – запавший ладъевидный живот.
Диагностика
Главным методом дородового выявления врожденной диафрагмальной грыжи является эхография. При ультразвуковом исследовании подозрение на этот порок возникает при аномальном изображении органов грудной клетки. Одним из основных эхографических признаков, является смещение сердца, а также появление в грудной клетке желудка и петель тонкого кишечника. Пренатальное ультразвуковое исследование может выявить наличие содержимого брюшной полости в грудной клетки уже на 12 неделе беременности. Тем не менее, обычно диагноз ставится на 16-неделе беременности.
Ранняя диагностика ВДГ дает возможность провести кариотипирование, для исключения сочетанной хромосомной аномалии. Так же по данным УЗИ в I и II-м триместре беременности есть возможность определиться в необходимости фетальных вмешательств для стабилизации плода с ВДГ.
После рождения диагноз ВДГ подтверждается после проведения комплексного УЗИ и рентгенографии органов грудной и брюшной полости.
Методы лечения
При рождении ребенка с диафрагмальной грыжей врачи должны быть готовы к проведению расширенной сердечно-легочной реанимации. Интубация трахеи и ИВЛ показана с первой минуты жизни. Уже в родзале ребенок с ВДГ может потребовать введение лекарственных препаратов, стабилизирующих работу сердца. Только достигнув стабильного состояния, возможна транспортировка ребенка из родзала, она выполняется в условиях транспортного кувеза на ИВЛ с мониторингом жизненных функций.
В условиях реанимационного блока отделения продолжается интенсивная терапия, направленная на стабилизацию состояния и подготовке к операции: подбор методов и параметров ИВЛ, кардиотоническая поддержка, седативная и обезболивающая, антибактериальная терапия.
По мере стабилизации состояния решается вопрос о возможности оперативного лечения.
В случае нестабильности состояния в нашем отделении есть возможность использовать методику экстракорпоральной методики поддержки работы сердца и легких – ЭКМО.
Оперативное лечение детей с ВДГ осуществляется преимущественно малоинвазивным эндоскопическим методом. Через минимальные проколы грудной клетки (3 мм) осуществляется бережное погружение содержимого из грудной полости в брюшную. После чего оценивается дефект диафрагмы: в случае достаточно развитой собственной диафрагмы пластика дефекта осуществляется собственными тканями, а при выраженном дефиците тканей – дефект замещается имплантом (используется синтетический материал Гор-Текс и биологический материал Пермакол).
В послеоперационном периоде продолжается интенсивная терапия, направленная на коррекцию дефицитов, которые сохраняются, пока гипоплазированное легкое не восстановится.
В ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России Вы получаете уникальную возможность получить БЕСПЛАТНО оперативное стационарное лечение по квотам на высоко-технологическую медицинскую помощь (ВМП по ОМС).
Источник

Врожденная диафрагмальная грыжа — порок развития, связанный с выходом органов брюшной полости через дефект в диафрагме в грудную клетку. Данная патология влечет за собой развитие легочной гипоплазии из-за сдавления легочной паренхимы, что приводит к развитию дыхательной недостаточности после рождения и высокой неонатальной смертности. Ранняя хирургическая коррекция данного порока позволяет частично устранить последствия данного порока и уменьшить количество летальных исходов среди новорожденных, но существует и иной, более эффективный способ коррекции этой патологии. В данной статье мы рассмотрим способ внутриутробной коррекции дефекта с помощью баллонной окклюзии трахеи.
В норме закрытие плевроперитонеального отверстия, соединяющего грудную и брюшную полость, должно произойти на восьмой неделе гестации. Одновременно происходит развитие кишечника плода, его удлинение и ротация. Если по каким-то причинам закрытие отверстия в диафрагме не состоялось, петли кишечника выходят в грудную клетку.
Охарактеризовать диафрагмальные грыжи можно по нескольким параметрам. Выделяют ложные и истинные диафрагмальные грыжи. Ложные диафрагмальные грыжи формируются в результате нарушения соединения зачатков диафрагмы между собой. Истинные диафрагмальные грыжи связаны с нарушением процесса формирования диафрагмальных мышц. Также в зависимости от локализации дефекта выделяют:
- Диафрагмально-плевральные (ложные и истинные);
- Парастернальные;
- Френоперикардиальные;
- Грыжи пищеводного отверстия.
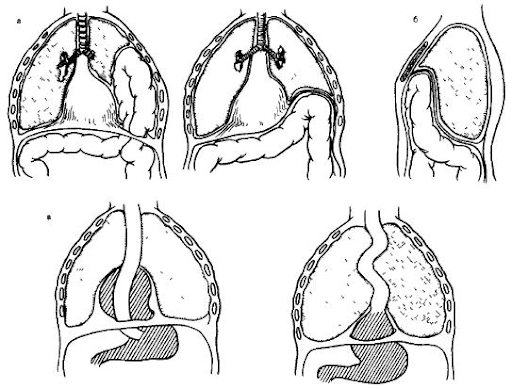
Рисунок 1 | а — диафрагмально-плевральные грыжи (истинная и ложная), б — парастернальная грыжа, в — грыжи пищеводного отверстия (параэзофагеальная, эзофагеальная)
Наиболее часто у детей встречаются диафрагмально-плевральные грыжи и грыжи пищеводного отверстия диафрагмы. Парастернальные грыжи встречаются редко, еще реже — френоперикардиальные. Грыжевое содержимое зависит от локализации дефекта; наиболее часто наблюдается выход петель кишечника, участка печени. Грыжа пищеводного отверстия диафрагмы часто сопровождается смещением желудка вверх и его расположением рядом с пищеводом.
Врожденные диафрагмальные грыжи сопровождаются легочной гипоплазией, степень развития которой влияет на выживаемость детей с данным пороком. Внутриутробная компрессия легких, связанная с выходом в грудную клетку содержимого брюшной полости, замедляет их развитие. Также происходит нарушение дыхательных движений плода из-за механического сдавления, в результате чего уменьшается количество бронхиальных ветвей и альвеол, поражается сосудистая сеть легких.
Внутриутробная коррекция дефекта заключается во введении баллона в трахею плода с помощью фетоскопа. Прежде чем подробно рассмотреть данный метод коррекции, необходимо вспомнить физиологию дыхательной системы плода. В норме легкие плода продуцируют жидкость на протяжении всего периода гестации и выделяют ее через верхние дыхательные пути в амниотическую жидкость. Определенный объем жидкости необходим для стимуляции местных факторов роста. С помощью баллона, установленного в трахее, уменьшается отток продуцируемой жидкости, следовательно, стимуляция факторов роста усиливается.
Вмешательство предпочтительно проводить между 26–30 неделями гестации, т. к. введение баллона раньше этого срока может повлечь за собой повреждение трахеи. Фетоскоп вводится в амниотическую полость и подводится ко рту плода, избегая плаценты. Далее его вводят в ротовую полость и продвигаются вдоль гортани, трахеи до бифуркации, после чего баллон раздувается с помощью введения 0,8 мл физиологического раствора. После того как врач убедится в правильной позиции баллона посредством фетоскопии или УЗИ, устройство отсоединяется от микрокатетера. После оценки состояния плода и матери фетоскоп извлекается, и процедура считается завершенной. Беременная женщина находится под наблюдением в стационаре первые 24–48 часов с непрерывным мониторингом состояния плода, далее контроль состояния плода и положения баллона производится каждые две недели до родов.
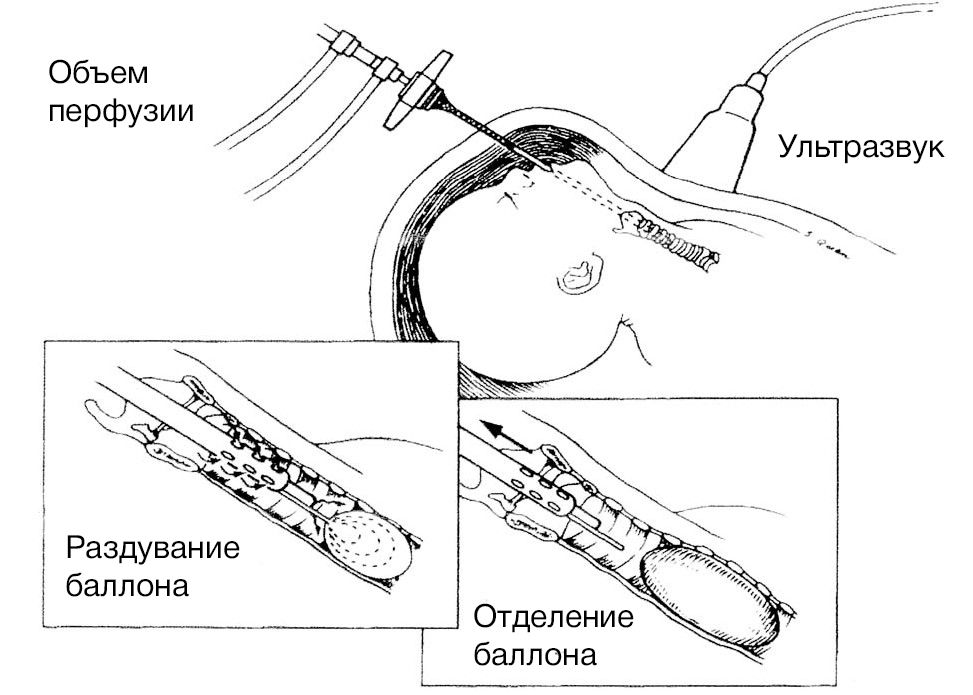
Рисунок 2 | Методика введения баллона с помощью фетоскопа
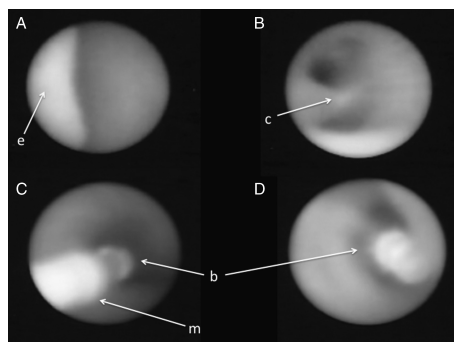
Рисунок 3 | Техника баллонной окклюзии трахеи на 26 неделе гестации. А — надгортанник плода (е), В — бифуркация трахеи (с), С — баллон (b) c микрокатетером (m), D — баллон (b) после раскрытия.
Удаление баллона производится на 34 неделе с помощью повторной фетоскопии или прокола баллона под контролем УЗИ.
В течение четырех-восьми недель легкое усиленно развивается, значительно увеличивается в размере, вытесняя органы брюшной полости. Таким образом, одновременно достигается уменьшение гипоплазии легкого и вправление грыжевого содержимого.
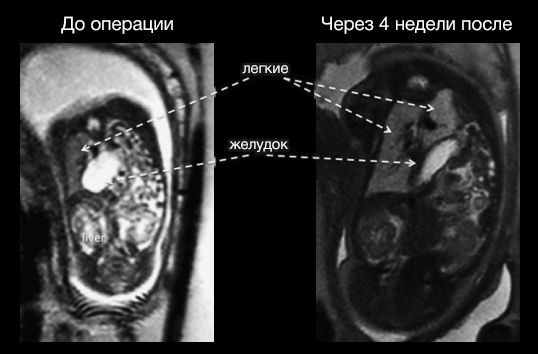
Рисунок 4 | МРТ до проведения процедуры (слева) и спустя 4 недели после установки баллона (справа).
Преимущество метода баллонной окклюзии трахеи перед постнатальным оперативным вмешательством подтверждено многими исследованиями. Отмечается высокая выживаемость по сравнению с «выжидательной» тактикой; процент легочной гипоплазии среди детей с дородовым вмешательством ниже, а оценка по шкале Апгар на 1 и 5 минуте выше, чем у детей без коррекции порока. Учитывая, что врожденная диафрагмальная грыжа связана с высоким уровнем неонатальной смертности, данный метод коррекции является наиболее перспективным.
Источники:
- Э.М. Колесников. Диагностика и лечение диафрагмальных грыж у детей: учебно-методическое пособие/ Минск: БГМУ, 2014.
- Ю.Ф.Исаков. Хирургические болезни детского возраста. Учебник в 2т. / Москва – ГЭОТАР-МЕДИА, 2004. – Т.1.
- Неонатология. Национальное руководство. Москва – ГЭОТАР-МЕДИА, 2009.
- Павличенко М.В., Косовцова Н.В., Маркова Т.В. Опыт баллонной окклюзии трахеи при вторичной гипоплазии легких у плодов с врожденной диафрагмальной грыжей. Российский вестник акушера-гинеколога, 2018.
- Ruano R, Yoshisaki CT, da Silva MM, Ceccon ME, Grasi MS, Tannuri U, Zugaib M. A randomized controlled trial of fetal endoscopic tracheal occlusion versus postnatal management of severe isolated congenital diaphragmatic hernia. Ultrasound in Obstetrics and gynecology 2012; Vol. 39
- Ruano R, Ali RA, Patel P, Cass D, Olutoye O, Belfort MA. Fetal endoscopic tracheal occlusion for congenital diaphragmatic hernia: indications, outcomes, and future directions. OBSTETRICAL AND GYNECOLOGICAL SURVEY. Vol. 69
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
