Никелид титана при грыжах

— [ Страница 2 ] —
Рис.1. Материалы, использованные для экспериментальной имплантации, и соотношение удельной площади их поверхности.
а – политетрафторэтилен; б – пролен; в – никелид титана.
Согласно фундаментальным исследованиям, выполненных В.Э. Гюнтером и др. (1986, 1994 гг.), никелид титана – отечественный имплантационный материал последнего поколения, который обладает качествами биосовместимости, не подвержен коррозии, не вызывает аллергических реакций и устойчив в любой агрессивной биологической среде. Биомеханические характеристики (эластичность и гистерезис) никелида титана весьма близки к таковым у живых тканей. Материал стерилизуется любым известным в ветеринарной медицине способом, полностью сохраняя свои физико-химические свойства.
Объектом экспериментальных исследований были 26 беспородных собак обоего пола в возрасте от 4 мес. до 6 лет. По предложенной методике хирургическим путем моделировались сквозные мышечно– апоневротические дефекты брюшной стенки, в которые имплантировались конструкции из материалов – политетрафторэтилена, пролена и никелида титана.
Отбор животных для экспериментальных исследований, уход, экспериментальные исследования и оперативные вмешательства проводились в соответствии с действующими санитарно-эпидемиологическими нормами и правилами, в соответствии с ветеринарным законодательством РФ, Правилами проведения работы с использованием экспериментальных животных, а также приказом МЗ СССР № 755 от 12.08.77г. «О мерах по дальнейшему совершенствованию организационных форм работы с использованием экспериментальных животных».
Операции проводились с соблюдением асептики и антисептики. Стерилизация инструментов и имплантатов из никелида титана осуществлялась сухожаровым способом. Имплантаты из политетрафторэтилена и пролена и одноименный шовный материал – в стандартной стерильной упаковке.
Операции проводились под общим обезболиванием. В качестве премедикации использовались инъекции атропина 0,1% и димедрола 1%, в зависимости от веса животного. Для основного наркоза применялись 2% раствор рометара внутримышечно и 1 % пропофол внутривенно в дозировке, соответствующей весу животного. Местную анестезию не использовали.
По схеме моделирования дефекта (рис.2) разрезом в одной из обозначенных для имплантации областей брюшной стенки выполнялись разрезы для доступа к мышечно-апоневротическому слою. Затем иссекались ткани мышечно-апоневротического слоя до брюшины с формированием дефекта размером около 5 Х 5 см. В дефект мышечно-апоневротического слоя вшивался подобранный по размеру дефекта имплантат с фиксацией одноименным шовным материалом с дистанцией между швами около 1см. По отношению к мышечно – апоневротическому слою имплантат располагался предбрюшинно (sublay). Кожа с подкожной клетчаткой ушивалась над дефектом и имплантатом наглухо без дренирования.


Рис. 2. Схема экспериментальной модели дефекта брюшной стенки и пластики дефекта имплантатом.
В послеоперационном периоде использовались обезболивающие (анальгин) в течение 1 – 2 суток. Другая лекарственная терапия, включая антибиотики, не использовалась. В первые сутки – двое собаки находились в отдельных палатах. В последующем животные переводились на общее или вольерное содержание. Особых ограничений в питании животных не устанавливали.
В послеоперационном периоде вели клинический контроль, включающий термометрию, оценку общих и местных изменений со стороны послеоперационной раны. Анализы крови из периферической вены выполняли перед операцией, а также на 14 день после операции. Анализы крови включали количество эритроцитов, гемоглобин по общепринятой методике. В мазках крови, окрашенных по Романовскому – Гимзе, проводился подсчет лейкоцитов и выводилась лейкограмма по общепринятой методике. Общий белок, сахар и билирубин крови исследовались фотокалориметрическим способом.
В целях изучения формирования соединительной ткани и цитологической реакции на имплантат по истечении 14, 30, 90, 180 дней и 1 года выполнялась ножевая биопсия из зоны имплантации с частью имплантата (рис.3).

Рис. 3. Схема биопсии из зоны имплантата
Биопсия выполнялась под общим обезболиванием в условиях операционной с соблюдением необходимых требований асептики и антисептики. По ходу биопсии оценивались макроскопическое расположение имплантата, состояние тканей в зоне имплантации, наличие скопления тканевой жидкости, характер роста соединительной ткани, формирование грануляционной капсулы, прорастание вновь образованной соединительной ткани, ее связь с имплантатом и тканями, окружающими имплантат. Дефекты в зоне имплантации восстанавливались с помощью одноименного шовного материала с ушиванием операционной раны наглухо.
Взятый при биопсии материал и тканевая жидкость на 14 и 30 день размещались в стерильные контейнеры или пробирки с последующим бактериологическим исследованием. Для бакпосевов использовались среды Эндо, Сабуро и мясо-пептонный агар. Проводилась культуральная и биохимическая идентификация микрофлоры. Изготовление препаратов, их окраска, микроскопия и идентификация микрофлоры выполнялись по общепринятой технологии специалистами-бактериологами, имеющими опыт экспериментальной бактериологии.
Тканевой биопсионный материал для гистологического исследования фиксировался в 10% растворе нейтрального формалина с последующей заливкой в целлоидин-касторовом масле – парафине. Срезы блоков выполняли на ротационном микротоме толщиной 5 мкм. Окраска препаратов проводилась гематоксилином и эозином, пирофуксином по Ван-Гизону.
Стереоультраструктурные исследования биопсионного материала с использованием сканирующей электронной микроскопии проведены на базе Российского научного центра «ВТиО» им. академика Г.А.Илизарова. Биопсионный материал фиксировался в фиксирующей смеси 2% параформальдегида, 2% глютарового альдегида, 0,1% раствора пикриновой кислоты на 0,1М фосфатном буфере при pH 7,4 в течение 7 суток при температуре +5-6°С. Исследование препаратов проводилось по методу отраженных электронов на сканирующем электронном микроскопе GEOL–JSM-840 Scanning microscope (Яп.) с ускоряющим напряжением 20 кэВ по программе Oxford Jnd. JNKA – 200.
Для проведения трансмиссионной электронной микроскопии образцы соединительной ткани, образовавшейся вокруг имплантатов, объемом 1 – 2 мм3 фиксировали 2% раствором параформальдегида и глютаральдегида, 1% раствором четырехокиси осмия, обезвоживали и заливали в аралдит. На ультрамикротоме LKB Bromma Ultratome Nova (Швеция) изготовляли ультратонкие срезы, монтировали их на предметные сетки, контрастировали растворами уранилацетата и цитрата свинца по Рейнольдсу и исследовали при помощи электронного микроскопа JEM-100B (Япония) при инструментальных увеличениях от 3000 до 60000 и ускоряющем напряжении 80 кэВ. Полученные изображения регистрировали на фотопластинки для ядерных исследований типа МР МК.
Статистическую обработку количественных данных проводили, используя пакет анализа данных приложения «Microsoft Exel» программного продукта «Microsoft Office». Для каждого момента данных определяли параметры описательной статистики. Достоверность межгрупповых различий полученных данных определяли по параметрическому критерию Стьюдента и непараметрическому критерию Вилкоксона-Манна-Уитни.
200
Источник
Сибирские специалисты работают с имплантатами на основе
никелида титана, проявляющими эффект памяти формы.
Инновационный медицинский материал давно с успехом
зарекомендовал себя в имплантологии и в настоящее время получил
широкое распространение во многих отраслях хирургической
медицины. Теперь на основании этого сплава
рассматриваются и внедряются различные методы
лечения.
Еще в 70-80-е годы прошедшего столетия в отечественной
и зарубежной медицинской практике нашли применение сплавы с
эффектом памяти. Такие материалы применяют в
реконструктивной и пластической хирургии. Они не просто замещают
отсутствующие органы и восполняют тканевые дефекты, но и
адаптируются к живым тканям.
Команда сибирских физиков, инженеров и клиницистов следует
научным традициям, разработанным профессором Виктором
Эдуардовичем Гюнтером, который и теперь возглавляет НИИ
медицинских материалов и имплантатов с памятью формы Сибирского
физико-технического института при Томском государственном
университете (НИИ медицинских
материалов при СФТИ ТГУ).
В. И. Гюнтер открыл закон запаздывания биологических тканей. То
есть, каким образом работает живая ткань в процессе нагрузки
и разгрузки, а точнее, в условиях функционирования организма, в
отличие от неживых материалов. Суть его в том, что
существует не линейная, а гистерезисная зависимость между
деформацией тканей и возвратом к её исходной форме. Это
свойство живых тканей стало обязательным условием при работе
с имплантируемыми в организм материалами, которые должны быть
прочными, пластичными, изно-, цикло- и коррозионностойкими.
Опираясь на знание особенностей поведения биологических
тканей, сибирские специалисты разработали технологии
получения сплавов, которые обладают термомеханической
памятью или памятью формы. В основе материала с памятью
формы (никелида титана), предложенного отечественными
учеными, лежит интерметаллическое соединение никеля и титана. При
охлаждении до +3°С такой сплав пластичен и поддается
деформации, а при нагревании до температуры тела принимает
исходно заданную форму. Учитывая такие важные параметры, стало
возможным использование таких сплавов для фиксации костных
тканей. Такие материалы отличают прочность конструкции и
биосовместимость, что в целом содействует эффективности
лечения.
Недавно российские специалисты в сотрудничестве с зарубежными
коллегами представили критический обзор в
международном рецензируемом издании Materials (2019,
12, 2405). Здесь основное внимание
уделено вопросам создания и внедрения имплантатов на основе
никелида титана, изучаемым в ходе многолетних
экспериментальных исследований, кроме того, рассмотрено
клиническое применение этих материалов в разных отраслях
медицины, в частности, в челюстно-лицевой хирургии,
стоматологии, травматологии, ортопедии, а также при
создании криоинструментов.
Андрей Анатольевич Радкевич – практикующий врач в области
челюстно-лицевой хирургии, доктор медицины, профессор кафедры
хирургической стоматологии челюстно-лицевой хирургии
Красноярского медицинского университета имени В. Ф.
Войно-Ясенецкого, ведущий научный сотрудник Института
медицинских проблем Севера ФИЦ КНЦ СО РАН (г. Красноярск) –
совместно с коллегами-единомышленниками 30 лет
занимается разработкой инновационных методов
реконструктивной хирургии с использованием никелида титана для
материалов с эффектом памяти и внедрением их для разных
задач хирургии. Сибирский ученый-практик рассказал, в чем
состоит специфика имплантационных материалов, какие существуют
виды имплантатов и каким образом они
функционирует в организме человека.

На фото – Радкевич Андрей Анатольевич – доктор мед. наук, профессор кафедры хирургической стоматологии челюстно-лицевой хирургии Красноярского медицинского университета имени В. Ф. Войно-Ясенецкого, ведущий научный сотрудник Института медицинских проблем Севера ФИЦ КНЦ СО РАН (г. Красноярск)
«Проблема реконструктивной хирургии до сих пор остается
актуальной. В чем она заключается? В том, что в реабилитации
больных данной категории необходимо с наибольшей эффективностью
заместить утраченные ткани и органы. Например, от опухоли
пациента избавили, но одномоментно перевели в разряд
инвалидов, –
Андрей Радкевич отмечает главную задачу врача,
работающего с имплантатами,
и поясняет, какова специфика таких
материалов –
Для того, чтобы устранять тканевые дефекты, существуют
трансплантационные и имплантационные материалы.
Трансплантационные материалы – это материалы, имеющие
биологическую природу, например из одной части тела забрали
и к другой части пересадили у одного человека, или
пересадили от трупа или от животного. Но есть недостатки:
собственные ткани пересаживать – это
дополнительная операционная травма. Еще минус,
например, ребро не повторяет форму челюсти – не
тот результат. Плюсы – это собственная ткань, она
прирастает и не отторгается.
Существуют другие трансплантационные материалы, например,
аллогенные (от человека) и ксеногенные (от животных). Но
это мертвая ткань. Мертвое все-таки к живому плохо
приживается. Организм должен отторгнуть и заместить чем-то
своим. Это не всегда соответствует задачам операции. Может
быть рубец на кости».
Напротив, имплантационные материалы, как
сообщил профессор Андрей
Радкевич, «повторяют изъяны человека, их
можно индивидуально изготовить и не надо забирать свои
ткани. К имплантационным материалам предъявляют важное требование
– биологическая совместимость. В этом случае, не надо
травмировать другие ткани человека и можно повторить
форму изъяна. Другое важное требование –
биохимическая совместимость (то есть, когда имплантационный
материал не вступает в химическую реакцию с
биологическими жидкостями – с кровью или лимфой). Мало того,
чтобы имплантат функционировал в организме и не
только вступал с химическую связь, он должен при
нагрузке и разгрузке восстанавливать исходную форму, подобно
живым тканям».
Имплантационные материалы делятся на индуктивные (при
установке этих материалов своя кость растет) и кондуктивные
(это дефект или дырка в кости, которую нужно закрыть
другим куском).
«Многие зарубежные материалы – кондуктивные. Наши
материалы, в отличие от других, при нагрузке и разгрузке
ведут себя так же, как биологическая ткань. Мы
создали металлический материал, который не
вступает в химическую реакцию и может принимать
исходную форму, как живые ткани. Это
биосовместимые материалы», – подчеркнул
профессор Андрей
Радкевич.
Пористые сплавы TiNi показали высокий уровень биоинертности,
биосовместимости и биомеханики in vivo в течение периода
имплантации в организме. Их изучали экспериментальным путем
в НИИ медицинских материалов и имплантатов с памятью формы
Сибирского физико-технического института и затем
эксплуатировали никелидтитановые конструкции, имплантируя в
организм больных разного рода травм и поражений.
Материалы на основе этого сплава, по замечанию
профессора Радкевича, «при нагрузке и
разгрузке после установки в организм ведут себя
точно так же, как и окружающие ткани:
деформируются и восстанавливают исходную форму,
а не разрушаются, например, в отличие от титановых
сплавов. Это их главное преимущество».
Кроме того, материалы с эффектом памяти формы TiNi
имеют разную геометрическую форму.
«Материалы на основе никелида титана, которые мы применяем
для имплантации в организм, бывают пористые, монолитные
сетчатые, тканевые. Имеют разную структуру для разных
задач. Например, если кости черепа или
лобные кости нужно заместить – то
используют пластинчатые имплантаты, а если глазное
дно, а там травма, оскольчатый перелом и
глазное яблоко опускается, – то применяются
сетчатые имплантаты», – пояснил профессор
Радкевич.
Рисунок 1. Сверхэластичный тонкопрофильный сетчатый имплантат на основе никелида титана
Каким образом можно наблюдать проявление эффекта памяти
формы?
«Например, монолитные материалы применяются как
скобы для фиксации ткани. Берется скоба́ и нагревается до
400°С или 700°К, а проволока может быть разной
толщины (1, 5 мм или 0, 8 мм) в зависимости от того,
для детей или для взрослых, и какое усилие будет
развиваться. Затем она изгибается в виде скобы,
например, в виде разомкнутого равнобедренного
треугольника, её охлаждают до +3°С и ниже
– и мы можем ее гнуть, как пластилин. При 35°С
и выше она снова принимает ту же форму, которую ей надо
держать, и скобы фиксируются. Это и есть память формы», –
ответил Андрей Радкевич.



На рисунках вверху слева и внизу – имплантаты из ТН-10
для фиксации костных тканей, вверху справа – пористые
имплантаты из никелида титана (ТН-10)
Но так же работает эффект памяти формы не только в
травматологии. Например, этим же способом пользуются для фиксации
трансплантатов в онкологии и стоматологии. В таком
случае берут пористый материал, как губка (см. Рисунок
3).

Рисунок 3. Пористые имплантаты из никелида титана (ТН-10)
«Сквозь поры кость должна прорасти через этот
материал. Не вокруг облегать –
этого мало. Тогда пористая система и
этот имплантат станут единым целым. Нагрузка на
жевательные зубы 60-80 кг. Когда человек сжимает зубы, пористая
система деформируется, а разжимает – принимает
исходную форму. Кровь должна циркулировать, и за счет
этого кость будет живая в толще имплантата», –
объясняет Андрей Радкевич.
Чтобы полностью понять поведение сплава, а также срок
эксплуатации имплантатов на основе этого материала после
имплантации, нужно проверить его характеристики, такие как
устойчивость к повреждениям, биомеханические нагрузки,
анатомический результат. Эксперименты и медицинская практика
подтвердили физико-механические особенности никелида
титана.
Применение имплантатов на основе TiNi у пациентов с
травматическими повреждениями, при челюстно-лицевой
хирургии и иными заболеваниями показало высокий уровень
биосовместимости с живыми тканями. Кости выдерживают
нагрузку, имплантат хорошо приживается даже в
ранний послеоперационный период.
Андрей Радкевич поделился опытом клинических
наблюдений: «Например, при грыжах передней
брюшной стенки. Если пациента оперировали несколько раз и ее
рассекали, то со временем может развиваться несостоятельность
тканей передней брюшной стенки, что неизбежно ведет к развитию
грыжевых дефектов. Пластика местными тканями зачастую не
эффективна, поэтому многие хирурги используют сетчатые имплантаты
из пластмассы. Но пластмасса не обладает сверхэластическими
свойствами, за счет чего часто возникают рецидивы
заболевания.
А вот когда используем наши имплантаты, то получается
другой результат. Мы в зону дефекта устанавливаем сверхэластичный
сетчатый имплантат на основе никелида титана. Если больной
напрягает живот – имплантат растягивается, расслабил –
принимает исходную форму. Другими словами, он не
отрывается, а именно растягивается. Это и есть эффект
памяти формы в сплавах на основе никелида титана».
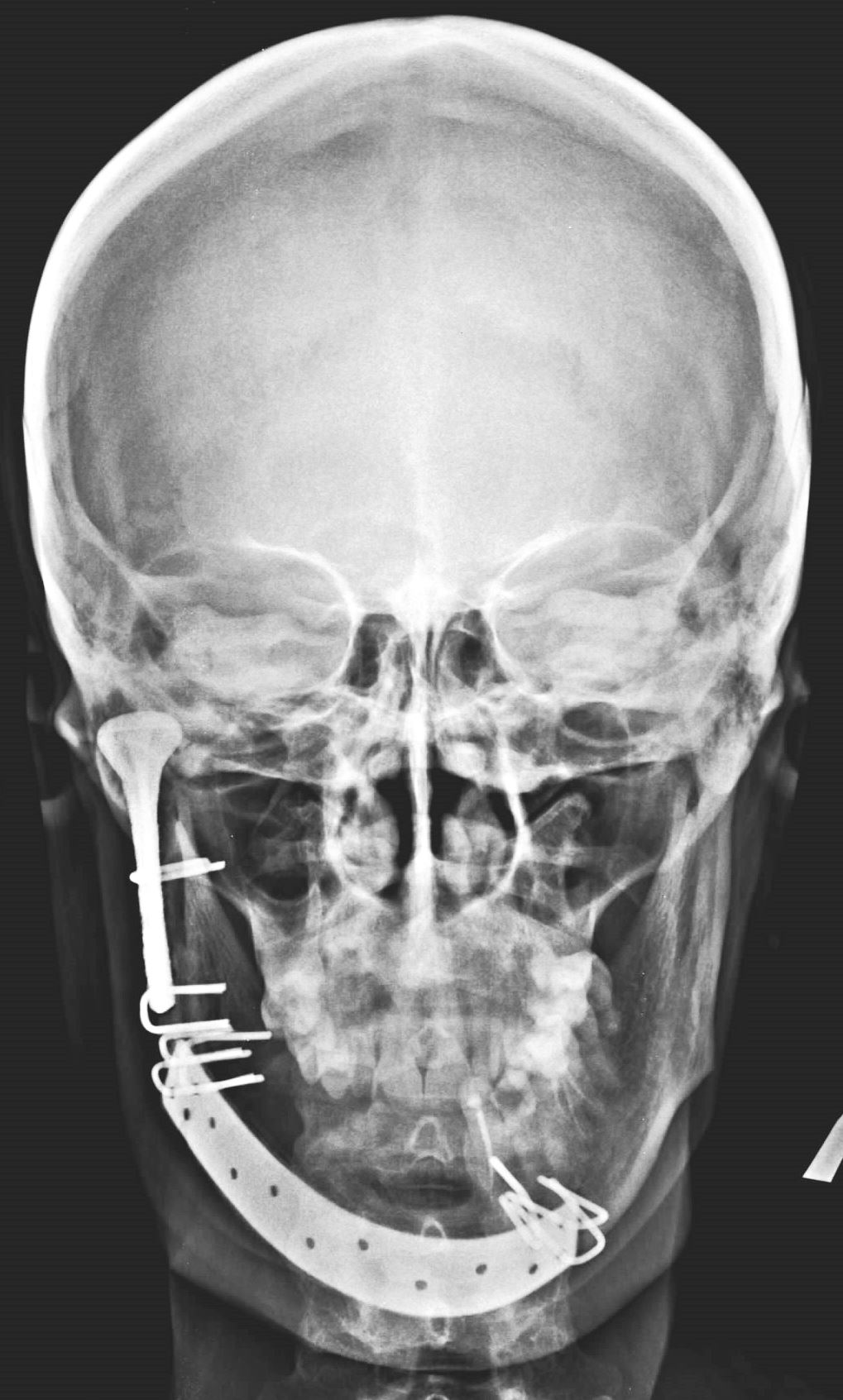
На снимке – рентгенограмма больной после замещения тела и правой ветви нижней челюсти по поводу амелобластомы и деструктивных изменений правой нижнечелюстной головки
Андрей Радкевич много лет провел у
операционного стола и является автором 55 патентов на
изобретение РФ. Предложенные и внедренные им методика и техника
операции с имплантатами содействуют восстановлению и
реабилитации больных.
«Я не ищу темы для научной работы. Пациенты сами их находят», –
непритязательно отвечает профессор
Радкевич на вопрос о планах работы с материалами с
эффектом памяти формы.
Механические свойства, параметры формовосстановления,
совместимость с биологическими тканями доказывают, что данный
материал является оптимальным современным решением с эстетической
и анатомической позиций для больных, нуждающихся в
имплантации.
Медицина служит человеку. Собранный и обобщенный опыт
врачебной и научной практики подтверждает, что
технология хирургического лечения с использованием такого
интерметаллического сплава, прежде всего,
содействует сохранению здоровья человека и,
конечно, открывает новые пути для профессионального
развития в разработке имплантатов следующего поколения и методов
лечения.
Источник
